2023年医用敷料的新的分类标准和管理
2023年7月13日,国家药品监督管理局医疗器械标准管理中心对外发布《2023年第二次医疗器械分类界定结果汇总》。该文件对医用辅料分类标准进行新的修订。
2023年7月13日,国家药品监督管理局医疗器械标准管理中心对外发布《2023年第二次医疗器械分类界定结果汇总》。该文件对医用辅料分类标准进行新的修订。
医用敷料主要用于清洁、覆盖创面,吸收体内渗出液,为创面提供愈合环境。部分医用敷料在手术中还可用于支撑器官或组织。它们在医疗卫生领域起到了重要作用。
近年来,医用敷料在化妆品行业的应用逐渐受到欢迎。由于作为医疗器械产品,它们比化妆品更卫生、更安全,因此受到了消费者的青睐。
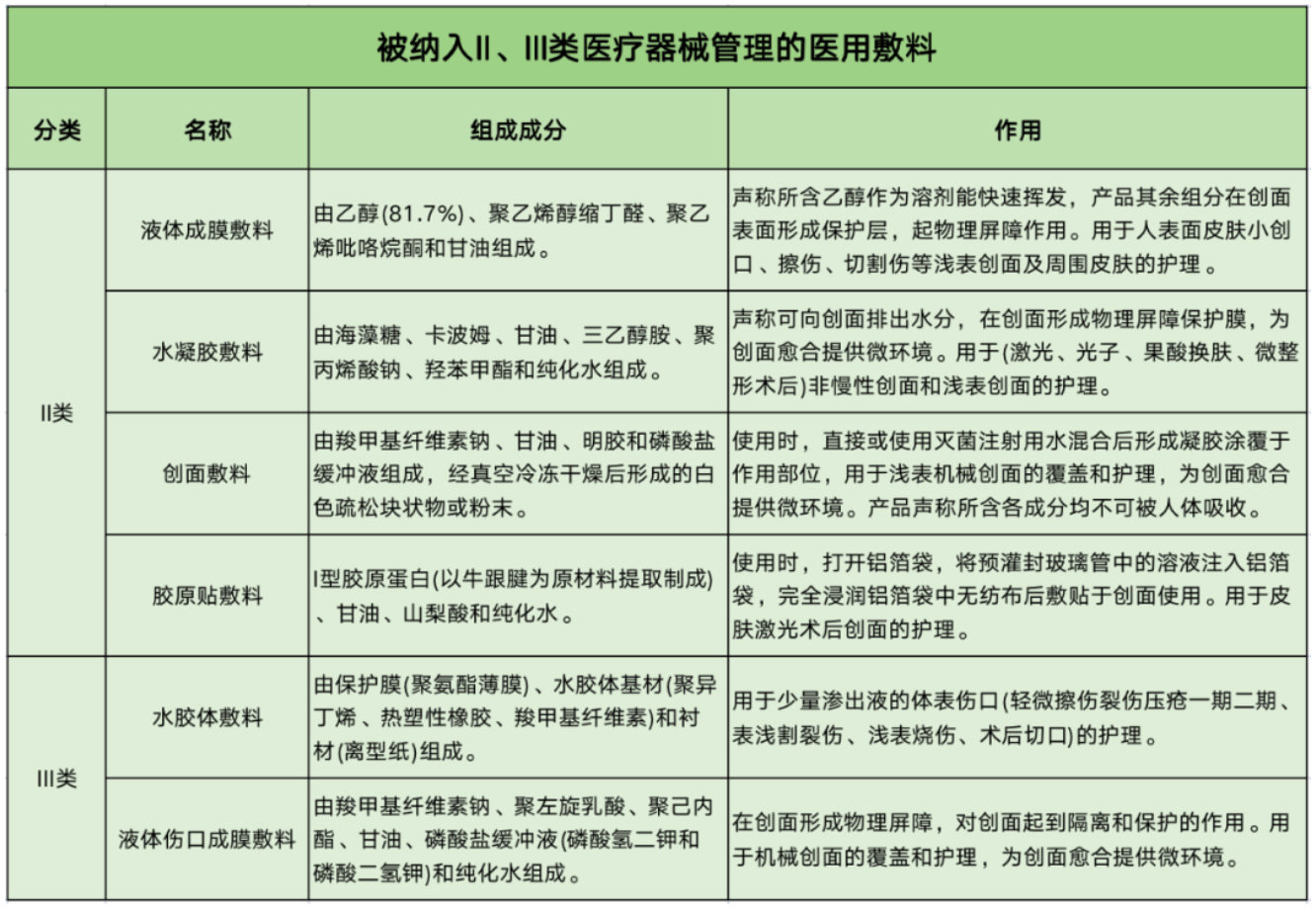
为了给相关生产企业提供更明确的标准和管理要求,并保障消费者的权益,此次共有6款医用敷料被列入II、III类医疗器械管理。
其中,用于细微创面护理的医用敷料如液体成膜敷料、水凝胶敷料、创面敷料被列入II类医疗器械管理;用于较大创面或较高风险的创面护理的医用敷料如:胶原贴敷料、水胶体敷料、液体伤口成膜敷料被列入III类医疗器械管理。
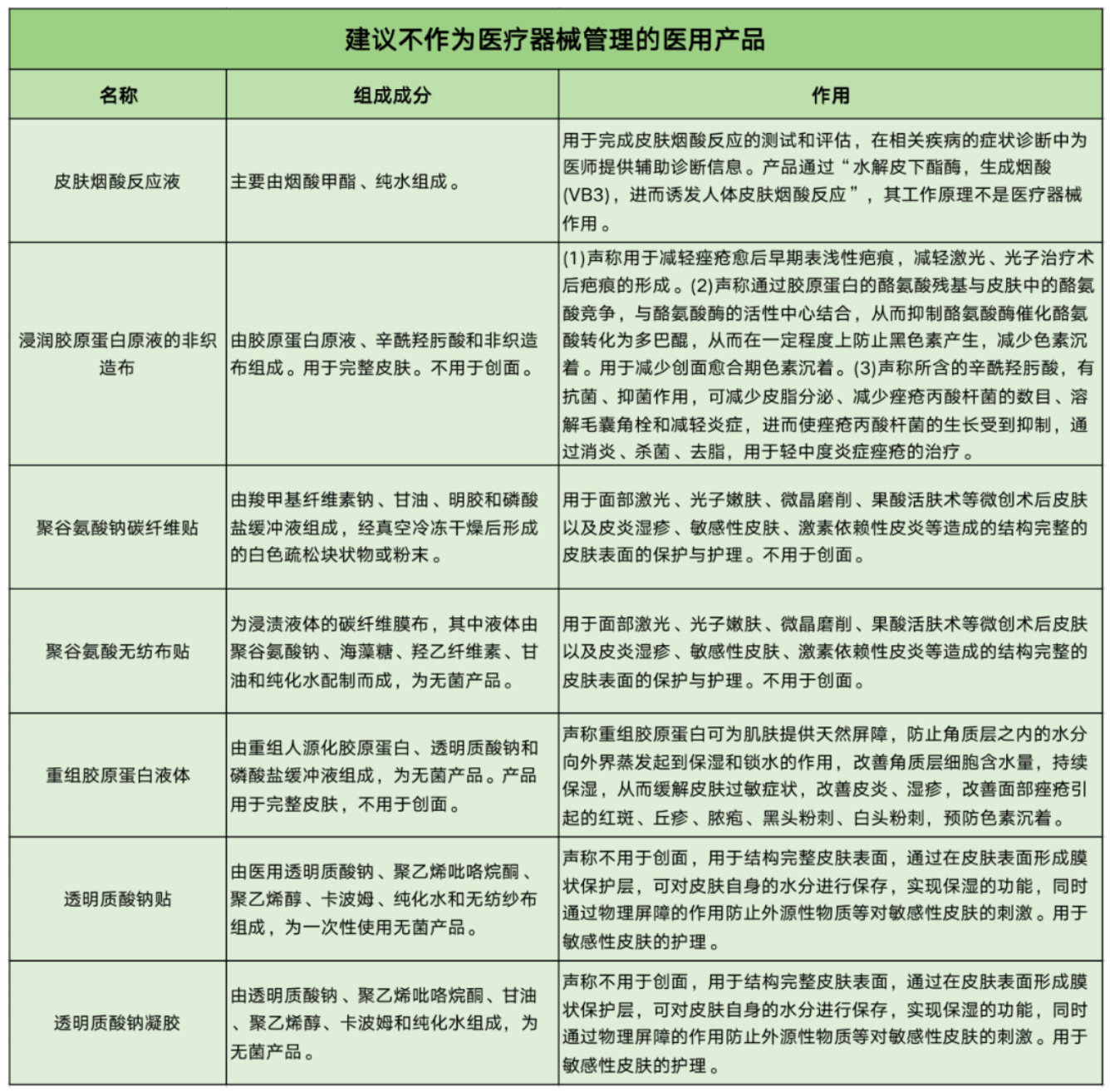
同时,还有7类产品因不用于创面,或只用于结构完整的皮肤表面的保护与护理,被建议不纳入械字号管理。这7类产品包括皮肤烟酸反应液、浸润胶原蛋白原液的非织造布、聚谷氨酸钠碳纤维贴、聚谷氨酸无纺布贴、重组胶原蛋白液体、透明质酸钠贴和透明质酸钠凝胶。
I、II、III类医用敷料医疗器械产品如何管理?
当医用敷料被归为I类医疗器械时,其管理方式是实行产品备案。由于I类医疗器械的风险程度较低,常规管理即可满足要求。备案人需要向所在地设区的市级人民政府食品药品监督管理部门提交备案资料,并且不需要进行临床试验。
当医用敷料被归为II类医疗器械时,其管理方式是实行产品注册。由于II类医疗器械具有中度风险,需要采取更严格的管理措施。注册申请人需要向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料,并且需要进行临床试验。据了解,一个II类产品申报注册证的最短周期为八个月到一年,这个过程中需要付出大量的人力、物力和财力成本。
当医用敷料被归为III类医疗器械时,其管理方式同样是实行产品注册。由于III类医疗器械具有高风险,需要采取特别严格的控制管理措施。注册申请人需要向国务院食品药品监督管理部门提交注册申请资料,并且需要进行临床试验。
清阳工程可以承接三十万级、十万级、万级、千级、百级、十级等多种洁净度等级的医疗器械无菌车间的装修建设,
我们是17年的老牌净化工程公司,各项资质齐全,承接过近500项净化工程,经验丰富。
全国热线电话:18015531058或点击咨询在线客服!




